
3.1 Fizikalne lastnosti vode
Voda ima več enkratnih lastnosti,
ki jo ločijo od drugih snovi: vrelišče, sprememba gostote v odvisnosti od temperature,
specifična toplota, topljivost snovi ipd. (preglednica 3.1). Vzrok za to je
v molekularni strukturi vode. Molekula vode je sestavljena iz dveh atomov vodika
in enega atoma kisika (H2O) (slika 3.1).

Slika
3.1. Molekularna struktura vode (Berner in
Berner, 1987).
Preglednica 3.1. Lastnosti vode v tekočem agregatnem
stanju (Berner in Berner, 1987).
| lastnost
|
primerjava z drugimi
snovmi |
pomen za okolje |
|
gostota |
maksimalna
pri 4o C in ne na točki taljenja, širjenje snovi po zmrzovanju |
V
jezerih voda ne zmrzuje do dna (pojav sezonske stratifikacije). |
|
temperaturi taljenja in vrenja |
nenormalno
visoki |
Omogočata
obstoj vode v tekoči fazi na površini Zemlje. |
|
toplotna kapaciteta |
višja
kot pri kateri koli tekočini, razen pri amoniaku |
Izenačuje
temperature na Zemlji in preprečuje ekstreme. |
|
toplota izhlapevanja |
ena
od največjih znanih vrednosti |
Pomembna
je za prenos toplote v atmosferi. |
| površinska napetost |
zelo
visoka |
Oblikuje
kapljice dežja. |
| absorbcija
radiacije |
močna pri infrardečih
in ultravijoličnih žarkih, manjša v vidnem delu spektra |
Kontrolira biološko aktivnost
(fotosinteza) in temperaturo okolja. |
|
raztapljanje |
odlično
topilo za ionizirane soli in polarne
molekule |
Prenaša
snovi v hidrološkem krogu in bioloških
sistemih. |
Atomi so povezani v molekulo s
polarnimi kovalentnimi vezmi. Dva para elektronov atomov kisika sta prosta,
preostala dva pa tvorita z elektronoma vodika skupni elektronski par. Posledica
je neenakomerna napetost molekule. Ker je kisikova stran molekule elektronegativnejša,
je molekula električni dipol. Nastaneta dva pola, pozitivni pri atomu vodika
in negativni pri atomu kisika. Različna pola se privlačita in ta privlak imenujemo
vodikova vez. Vodikove vezi povezujejo molekule v asociate (H2O)x.
Zaradi vodikovih vezi ima voda višje tališče in vrelišče kot primerljive neasociirane
spojine H2S, H2Se in H2Te
(slika 3.7). Pri sobni temperaturi je voda v tekočem agregatnem stanju (slika
3.2). Če vodikovih vezi med molekulami vode ne bi bilo, bi bila voda pri sobni
temperaturi plin (Ball, 2003).
|
|
|
|
|
a) para |
b) tekoča voda |
c) led |
Slika 3.2. Voda v vseh treh
oblikah.
Omenjene vezi so samo deset– do
petdesetkrat šibkejše od vezi med atomi kisika in vodika v sami molekuli. V
ledu se te vezi oblikujejo v značilne tetraedalne povezave (slika 3.2c).
V tekoči vodi molekule niso tako
strnjeno in urejeno povezane, vseeno pa so vezi urejene (slika 3.2b). Tetraedalna
struktura molekularnih povezav je vzrok enkratnih lastnosti vode, ki jih nimajo
tekočine brez omenjenje strukture. Ko se led topi, se povezave v tetraedalni
strukturi lomijo, molekule pa se lahko povežejo bolj prosto in tudi bolj tesno
ena ob drugi. Posledica je pojav večje gostote vode tik nad točko taljenja.
O strukturi molekularnih povezav v tekoči vodi danes še teče razprava v znanstvenih
krogih (Berner in Berner, 1987). Poznanih je več modelov, zasnovanih na mešanici
različnih molekul vode. Najpreprostejši modeli vsebujejo dva tipa molekul (z
vodikovimi vezmi in brez njih), bolj zapleteni pa tudi pet različnih tipov molekul.
Vodik in kisik imata svoje izotope
(preglednica 3.2). Delež posameznih izotopov v vodi spreminja kemijske in biološke
reakcije vode. Izotopi so tudi naravna sledila in njihova količina v vodi nam
omogoča ugotavljanje vira vzorca vode. Radioaktivni izotop vodika tricij se
je v večjih količinah pojavil v atmosferi kot posledica radioaktivnih poizkusov.
Razpolovni čas izotopa je 12.5 let in nam omogoča ugotavljanje "starosti
vode" po prenehanju poizkusov.
Preglednica 3.2. Značilnosti izotopov
vodika in kisika (Dingman, 1993).
| izotop |
delež izotopa [%] |
stabilnost |
|
1H |
99.985 |
stabilen |
|
2H deuterij |
0.015 |
stabilen |
|
3H tritij |
v
sledovih |
radioaktiven |
|
16O |
99.76 |
stabilen |
|
17O |
0.04 |
stabilen |
|
18O |
0.2 |
stabilen |
Pri taljenju ledu hidrogenske
vezi pokajo, gostota pa se hitro poveča, ker so molekule bolj zgoščene. Gostota
vode se po taljenju povečuje do temperature 40 C (bolj točno
3.980 C). Po maksimumu pri štirih stopinjah se gostota vode zvezno
zmanjšuje do vrelišča (slika 3.3). Ker je led lažji od vode, plava na površini,
zato voda v jezerih ne zmrzne do dna.
Hitro zmanjšanje gostote pri zmrzovanju
povzroča povečanje volumna ledu za 9 % in tlaka do 207 000 kPa, kar je dovolj
za trenje še tako močne kamenine. Pojav povzroča krušenje in erozijo kamenin
zaradi zmrzovanja vode v razpokah.
Elektrostatične lastnosti molekule
vode vežejo molekule vode z molekulami drugih snovi z zelo močnimi adhezijskimi
silami. Tako rekoč so vse higroskopne površine pri normalni temperaturi prekrite
s slojem adsorbirane vode, debeline nekaj deset molekul in vezane s silami,
ki presegajo 1012 Pa (Marsily, 1986) (slika 3.4). Posledica je oblikovanje
higroskopsko vezane vode v tleh.
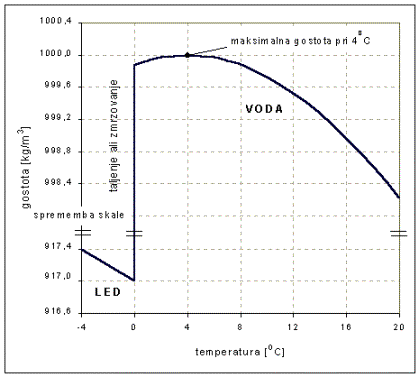
Slika 3.3. Soodvisnost med gostoto vode in ledu ter
temperaturo
Na stiku vode z zrakom se pojavi
površinska napetost kot posledica hidrogenskih sil, usmerjenih v notrajnost
vodnega telesa (slika 3.4). Površinska napetost je vzrok za sferično obliko
vodne kapljice. Dimenzija površinske napetosti je enaka sili, deljeni z razdaljo,
in se hitro zmanjšuje z zvišanjem temperature. Iz tega razloga je vroča voda
boljše čistilno sredstvo od hladne, saj lažje prodre v pore.
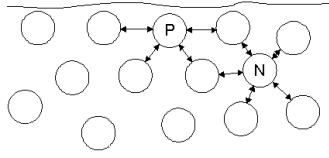
Slika 3.4. Sile med površinskimi (P) in notranjimi
(N) molekulami vode.
Pri temperaturi 200 C
znaša površinska napetost vode 0.073 Nm-1 (Maidment, 1992; Leeden et
al., 1990). Manjša količina vode na površini trdne snovi oblikuje kapljevino
(slika 3.5). Oblika kapljice je odvisna od lastnosti tekočine, trde snovi in
zraka oziroma od njihovih medsebojnih površinskih napetosti.

Slika 3.5. Kot q med meniskusom in steno (Dingman, 1993).
Kot med površino kapljevine in
trdno snovjo (slika 3.6) je določen z ravnovesjem tlakov:
![]() , enačba 3.1
, enačba 3.1
kjer je:
(tz)
trdna snov – zrak,
(tv)
trdna snov – voda in
(vz)
voda – zrak.

Slika 3.6. Mejna ploskev med zrakom, vodo in trdno
snovjo (prirejeno po Marsily, 1986).
Vrednosti kota ![]() za nekatere snovi so podane v preglednici 3.3 (Dingman, 1993). Za vodo
je pri hidrofilnih snoveh kot
za nekatere snovi so podane v preglednici 3.3 (Dingman, 1993). Za vodo
je pri hidrofilnih snoveh kot ![]() manjši od 900 in pri hidrofobnih večji od 900.
manjši od 900 in pri hidrofobnih večji od 900.
Preglednica 3.3. Vrednosti kota površinske napetosti
med vodo in različnimi trdnimi snovmi.
| trdna
snov |
kot površinske napetosti |
cos |
|
steklo |
0 |
1.0000 |
|
večina silikatnih mineralov |
0 |
1.0000 |
|
led |
20 |
0.9397 |
|
platina |
63 |
0.4540 |
|
zlato |
68 |
0.3746 |
|
smukec (lojevec) |
86 |
0.0698 |
|
parafin |
od 105 do 110 |
od –0.2588 do –0.3420 |
|
šelak |
107 |
–0.2924 |
|
vosek |
107 |
–0.2924 |
Pri gibanju vode, ki meji s trdno
snovjo, so hitrosti na meji zaradi vodikovih vezi enake nič. Z oddaljenostjo
od meje se hitrost postopoma povečuje, med molekulami vode pa zaradi različne
hitrosti prihaja do strižnih napetosti, opredeljenih s koeficienti viskoznosti
(preglednica 3.6).
Zaradi površinske napetosti
vode lahko lahki insekti hodijo po vodi, saj je njihova
teža premajhna, da bi predrli površinski film vode in s tem premagali površinsko
napetost. Površinska napetost vode je koristna tudi na taborjenju. Na šotorskem
platnu se ob dežju ustvari film vode, ki zaradi površinske napetosti napolni
pore v tkanini, ter s tem ustvari neprepusten ščit. Če se platna dotaknemo,
razbijemo površinsko napetost in šotor nam začne prepuščati vodo.
Vrelišče in tališče vode se razlikujeta glede na podobne snovi. Na sliki 3.7 so podani podatki
za vodo H2O, žveplov vodik H2S,
selenov vodik H2Se in telurjev vodik H2Te
v odvisnosti od molekularne teže. Če bi se voda obnašala kot druge podobne snovi,
bi bilo njeno vrelišče pri 800 C. Visoki točki vrelišča in tališča
ter velika razlika med njima omogočajo pojav vode v vseh fazah na površini Zemlje
in razvoj življenja na Zemlji, kot ga poznamo.
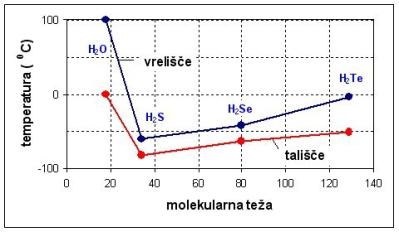
Slika 3.7. Vrelišče in tališče različnih snovi.
Specifična toplota vode je višja kot pri kateri koli znani tekočini z izjemo amoniaka. Del
toplotne energije, ki jo voda sprejema, se izkorišča za rahljanje vodikovih
vezi in ne samo za povečano gibljivost molekul. Visoka specifična toplota omogoča,
da večje količine akumulirane vode (jezera) svoje temperature ne spreminjajo
tako hitro (preglednica 3.6).
Toplota izhlapevanja znaša 2.454 MJkg-1 pri 20o C
in je ena od največjih (večjo ima samo vodikov peroksid) (preglednica 3.6).
Energija je potrebna za trganje vodikovih vezi med molekulami. Pojav je pomemben
pri prenosu energije v hidrološkem krogu, ko se pri izhlapevanju in kondenzaciji
med atmosfero in zemeljsko površino izmenjujejo ogromne količine energije. 23
% solarne radiacije, ki dospe na zemeljsko površino, se absorbira z izhlapevanjem
vode. Tudi človeško telo (sestavljeno iz 70 % vode) vzdržuje konstantno temperaturo
zahvaljujoč izhlapevanju. Do izhlapevanja prihaja tudi, ko je voda v trdi fazi.
Pojav se imenuje sublimacija
in zahteva približno 2.83 MJkg-1. Toplota taljenja je dosti manjša in znaša
eno sedmino toplote izhlapevanja (preglednica 3.6).
Voda je izredno prosojna, kar omogoča svetlobi, da doseže
v čisti vodi tudi globino stotih metrov in sproži procese fotosinteze. Za infrardeče
in ultravijolične žarke je voda močan absorbent. Infrardeče sevanje absorbira
tudi vlaga v zraku in tako vpliva na energetsko bilanco Zemlje.
Omenjene lastnosti vode so, poleg
temperature, odvisne od vrste in količine raztopljenih snovi v vodi. Tako na
primer pri morski vodi, ki vsebuje
veliko soli, ne zasledimo anomalije pri spremembi gostote in se po točki taljenja
njena gostota zvezno zmanjšuje (ni maksimuma pri štirih stopinjah). Zato lahko
voda v oceanih zmrzne do večjih globin.